- Fonction de nutrition : La matière -
(document disponible en format PDF : ICI)
1° Etats et Changement d’états
Les états :
Solide : état ordonné : molécules occupent des position quasi fixes
Liquide : désordonné condensé, molécules se déplacent le 1/ rap au autres ms occupent tjs 1espace déterminé : prend forme du récipient
Gazeux : état désordonné et dispersé. Molécules éloignées les unes des autres et se déplacent librement. Ils occupent tt l’espace dispo.
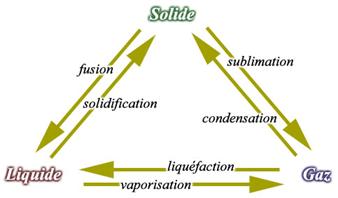
Le changement d’état s’effectue à température constante, mais cette température varie en fonction de la pression (normal = 1013 hPa)
Vaporisation – Evaporation – Ebullition
Vaporisation (L à G) : peut s’effectuer de 2 manières :
Vaporisation est limitée à la surface du liquide = évaporation
La vitesse d’évaporation d’un liquide dépend de sa nature, agitation, tx d’humidité, t°, surface > à n’importe quelle t°
L’eau ne disparaît pas mais se transforme en vapeur d’eau
Vaporisation a lieu à l’intérieur du liquide : ébullition à env 100°C
La formation de gaz se produit par l’apparition de bulles qui agitent le liquide restant
Masse et Volume
Lors d’un changement d’étant d’un corps pur, la masse est conservée mais le volume varie
Liquide occupe un volume plus important qu’à l’état solide
Lors de la solidification de l’eau, le volume augmente > cas exceptionnel de l’eau
Chaleur et Température
Elles ne sont pas toujours liées : lors d’un changement d’état, la t° est la même, mais il y a un apport de chaleur
2° Mélanges et Solutions
Mélange : substance constituée de différents corps
Différents type de mélanges
- homogène : dont l’aspect est identique de partout et où l’on ne distingue qu’un seul constituant et résulte de la dissolution d’un corps dans un autre. liquide ppl = solvant, liquide dissous = soluté, mélange = solution
- hétérogène : on distingue plusieurs un ou plusieurs éléments disséminés (huile dans l’eau). On leur donne ≠ noms :
suspension solide disséminé au sein d’un liquide
émulsion : gouttelettes de liquide disséminés dans un autre liquide
fumée : particules solides dans un gaz
mousse : bulles de gaz dans un liquide
brouillard : gouttelettes de liquide dans un gaz
Mélanges de liquides
Miscibles : se mélangent à l’eau (alcool, sirop, vinaigre, lait)
Soluble ou non soluble ?
Gaz dissous dans l’eau : oxygène permet la respiration des animaux aquatiques, ou encore le CO2 pour les boissons gazeuses
Solides dans liquides : sucre, sel, lessive, mais l’eau ne dissout pas les corps gras
Solubilité et vitesse de dissolution
Saturation : plus il y a de sel ds l’eau, plus la dissolution du sel supplémentaire est lente. Il arrive à un moment où le sel ajouté ne se dissout plus : la solution est saturée en sel. > utilisé pour les marais salants !
3 facteurs qui favorisent la dissolution :
Brassage du liquide provoquant la dispersion des molécules de soluté au sein du liquide
Elévation de la t° car molécule d’eau cassent l’édifice solide et dispersent les molécules de soluté
Surface de contact entre solide et liquide + gd surface + vite dissolution
Eau pure : constituée exclusivement de molécules d’eau H2O. L’eau naturelle n’est jms chimiquement pure
Eau potable : ne doit avoir aucun danger pour l’homme et ne contenir aucun élément biologique pathogène selon des seuils définies / UE
Eau en bouteille : source, minérale naturelle : provient des sources saines et protégées des risques de pollution. Seule l’eau minérale est naturelle et bénéficie de propriété reconnues car contient des sels minéraux et es oligoéléments
Mélange de 2 matières s’effectue avec conservation de la masse mais non du volume
Séparer les mélanges hétérogènes
Décantation : liquide avec liquide ou solide
Filtration : liquide / solide
Séparer les mélanges homogènes
Distillation : vaporisation (ébullition) et liquéfaction
Evaporation : mais il n’est pas possible de récupérer le liquide (marais salant)
3° Propriétés physiques des gaz
Grandeurs caractéristiques d’un gaz : t°, volume, pression, qtt de matière
1l de vapeur d’eau a une masse < à 1l de liquide
1kg de plomb a la même masse qu’1kg de plume, mais la ≠ c’est le volume
La vapeur d’eau ne se voit pas, du moment qu’on le voit, c’est de l’eau à l’état liquide
Brouillard : eau à l’état liquide en suspension dans l’air
Conservation de la matière :
s/ 1 paroi froide, l’eau à l’état gazeux se condense è 1 à 2g d’eau liquide vt se mettre dans le plateau è récipient c recouvert de buée !
Généralité sur l’air :
- c’est un mélange de gaz (diazote, dioxygène, autres (argon, dioxyde de carbone)
- invisible, incolore, insipide
- il est pesant
- ses 3 états : solide jusqu’à – 220°, liquide jusqu’à 190°, puis gazeux
- caracteristiques : pas de volume propore : il est comprésible et expansible. Il est désordonnée et dispersé et occupe tout l’espace disponible.


